毛囊存活率的重要性
人出生後不會增加一個毛囊,所以後枕的永久性毛囊,實乃無價之寶,不能取替。很多人寄望毛囊覆製,但成功之日遙遙無期,當務之急是在植髮過程中,將毛囊的創傷減至最低。在過去的 50 年中,已經進行了許多研究,以查看移植毛髮實際存活率,和生長的百分比,報告了以下發現:
• 頭髮是人體的一個獨立組織,視為一個可供移植的「器官」
• 和其他器官一樣,離開身體後必須小心保存,否則會壞死
• 受損的毛囊移植後未必能長出新的頭髮
• 一般要求至少 85% 的頭髮能正常生長
• 毛囊複製 cloning 遙望無期,增加毛囊生存率和減低損耗來得實際
• 損壞毛囊的原因可分為「 人為性 H-Factor 」 和 「 未知性 X-Factor 」
毛囊存活率影響捐髮區疤痕
• 毛囊損耗率過高,必須要提取更多的束數才能達到相同的效果
• 提出更多毛囊必須移取更濶的組織,所遺下的疤亦會增濶/p>
毛囊存活率與植髮效果
• 本中心 FUT 技術重視毛囊強化
• 是因為在植髮過程中受損的毛囊,若未能長出新頭髮,會影响最終的自然度及濃密度
• 美國 Dr. Beehner 強調植髮團隊的技術、合作性和經驗,是獲得滿意結果的最重要因素
• 醫生不僅要專注於毛囊的提取,而且要監察整個過程的每一個環節,及每一位隊友的表現。
• 植髮最終結果取決於實際生存毛囊的數量
毛囊存活率影響植髮次數
• 捐髮區的永久性頭髮有限,不必要的損耗,會減少將來可供移植的束數
• 亦相等於減少將來可植髮的次數
毛囊存活率影響植髮收費
• 不同植髮中心會有不同處理毛囊方法,不同毛囊生存率,不同最終效果,比較價錢時應比較
• 移植束數不足可能要進行另一次的修復性植髮,浪費時間及金錢
• 取出的毛囊若損耗率提高,會增加每一束毛囊的實際收費 (見下表)
植髮中心 A |
植髮中心 B |
|
|---|---|---|
每束列明收費 (HKD) |
25 |
25 |
| 所需毛囊束數 | 2,400 | 2,400 |
| 總收費 (HKD) | 60,000 | 60,000 |
| 植髮過程中毛囊的損耗率 | 20% | 2% |
| 損傷毛囊的數目 | 480 | 48 |
| 實際移植完整毛囊的數目 | 1,920 | 2,352 |
| 每束實際收費 (HKD) | 31 | 25.5 |
| 結論:高的存活率會減低植髮的成本和費用 | ||
影響毛囊存活的兩大因素
H-Factor 與 X-Factor
1984 澳大利亞的 Dr Richard Shield 提出了兩個會影響毛囊移植後存活率的因素:
• 不明因素 Unknown Factor 或 X-Factor
• 人為因素 Human Factor 或 H-Factor
X-Factor 的 " X " 代表影響毛囊移植後存活率的不明因素; 而人為因素 H-Factors 的 H 代表 human 人,即是指失敗原因乃基於人為因素,包括醫療團隊技術不足、疏忽,或病人未能依護理指引,大部份的 H-factor 是可以避免的,可發生在手術前後,或手術進行中。
損害毛囊的未知因素 : X-Factor

X-Factor 的 " X " 代表影響毛囊移植後存活率的不明因素因,澳洲的 Dr Shield 在 1984 年首次指出,某些人植髮後效果不理想,卻找不出合理的解釋。毛囊存活率低,直接影響最終的植髮效果。在早期基於植髮技術未夠元善,若出現不理想的效果,人為因素比例較大,不明因素衹佔非常小的 0.5-1%。隨著外科技術的進步和規範標準化,在過程中人為犯錯的機會大大減少,令不明因素 X-Factor 引致效果欠佳的比例日漸提高。有些植髮中心提供效果 100% 保證,是漠視了 X Facor 的存在。
X-Factor 可包括 :
• 再灌注缺血性損傷
• 自體排斥
• 未被發現的 H=Factor
再灌注缺血性損傷
根據多年研究,美國 Dr Jerry Cooley 指出毛囊由離開人體至重新植入的數小時內,都會因不同生化因素而遭捐毀 ( 見上圖 ), 稱之為 Reperfusion Ischaemic Injury 再灌注缺血性損傷。RII 可能是 X-Factor 的主因。
X-Factor 與毛囊存活率
綜合各地植髮權威的意見,一般相信所謂不明因素 X-Factor ,應是與毛囊的存活率有極大關係。近年全世界的焦點,亦由技術上的改進,轉移至生物科技 ( Biotecology ) 上。例如 Dr John Cole 研發的 A-Cell,BioLife 公司出產的低溫毛囊儲存液 Hypothermosol,Dr Cooley 及 Dr Marzola ATP,Dr Pathomvanich 的 William E Solution 。其他如 PRP ( Platelet Rich Plasma ),生長因子的應用,都是希望藉著改善毛囊移植後存活率,克服那些 X-Factors。
損害毛囊的人為因素 - H Factor

H 代表 human 人,即是指失敗原因乃基於人為因素,包括醫療團隊技術不足、疏忽,或病人未能依護理指引,大部份的 H-factor 是可以避免的,可發生在手術前後,或手術進行中。
手術前 H-Factor
• 頭皮血液循環不足. 吸煙
• 植入部位有皮膚病、疤 ...
• 不受控制的糖尿病
手術中 H-Factor
錯誤的毛囊提取方法
錯誤的毛囊提取方法會浪費含幹細胞的毛囊周圍組織,實驗證明,負責毛囊生長的幹細胞 Stem Cell,大部份儲存在毛囊的周圍組織,而非在髮根。移植毛囊時應盡量保留周圍組織,越多越好,1997 Dr Seager 己證實粗狀的毛囊,生存率遠高於纖幼的毛囊。在提取毛囊時必要保存這些重要的周圍組織,這點 FUT 絕對能做到,相反,微術植髮 FUE 因為是強行拔出毛囊,祇能保留較少的幹細胞
毛囊脫水
毛囊絕不能風乾,實驗證明祇要脫水五分鐘毛囊便會受損。脫水超過十分鐘, 96% 的毛囊不會長出頭髮,脫水超過二十分鐘, 100% 的毛囊不會長出頭髮,全軍覆沒。一定要確保取出的毛囊有充足的水份
錯誤的毛囊儲存方法
毛囊離開人體後,可在室温內保持 4 小時而不影响生存,若超過 4 小時則需儲存在冰箱內,保持在攝氏 4 度左右。一般常用的生理鹽水,不宜用於毛囊的低溫冷藏,此外,若冰箱温度低於 0 °C;, 會令細胞內的水份結冰,細胞核的內部會結成晶體而損壞再生功能,應盡量縮短毛囊離開身體的時間,減少風險
手術後 H-Factor
錯誤的手術後護理
例如不慎弄掉植入的頭髮、或洗頭水溫太高、傷口發炎、移植部位受創傷 ...
如何提升毛囊存活率

H Factor 風險 1 : 毛囊脫水
毛囊絕不能風乾,美國 Dr Gandlelman 的實驗證明祇要脫水五分鐘,毛囊細胞便會受損;脫水超過十分鐘, 96% 的毛囊不會長出頭髮; 韓國 Dr Kim 的實驗證明脫水超過二十分鐘, 100% 的毛囊不會長出頭髮,全軍覆沒。所以一定要無時無刻確保取出的毛囊有充足的水份。
風乾脫水時間 (分鐘) |
毛囊生存率 |
|---|---|
0 |
96 % |
| 5 | 94 % |
| 10 | 94 % |
| 20 | 83 % |
| 30 | 63 % |
處理方案
• 植入時勿將毛囊放在戴手套的手指上,應直接放入頭皮
• 採用 FUE 技術應避免將一日內移植起過 2,500 個毛囊 ( 5,000 條頭髮 )
• 避免使用植髮筆 Implanter
• 所有毛囊均放入低溫儲存液或濕潤的紗布墊中
H-Factor 風險 2 : 切除過量毛囊的周圍組織
去除毛囊周圍的過多組織,也會造成傷害,因為負責細胞再生的幹細胞,便位於毛囊周圍的組織。 1997 年的研究指出,保留外圍脂肪層的毛囊,移植後能存活得更好。
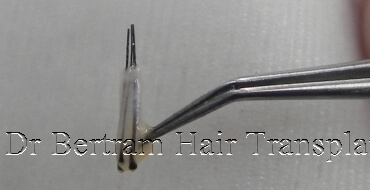
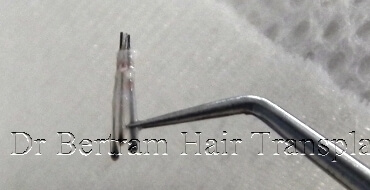
實驗證明,負責毛囊生長的幹細胞 Stem Cell,大部份儲存在毛囊的周圍組織,而非在髮根,移植毛囊時應盡量保留周圍組織,越多越好。1997 加拿大 Dr. Seager 己證實粗狀的毛囊 ( 稱為胖毛囊 Chubby Graft ),生存率遠高於纖幼的毛囊 ( 稱為瘦毛囊 Skinny Graft )。在 2010 年美國 Dr. Beehner 的研究也有相同的結論。
% 移植後 19 個月的生存率 |
瘦毛囊 Skinny Graft |
胖毛囊 Chubby Graft |
|---|---|---|
一束兩條頭髮的毛囊 |
69.3 % |
88.0 % |
| 一束一條頭髮的毛囊 | 48 % | 98 % |
處理方案
• 使用顯微鏡切割來保存含有幹細胞的組織
• 採用 FUE 微創技術時,盡量使用較大直徑的圓刀 Punch
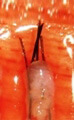
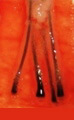
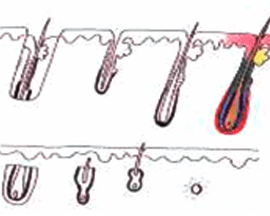
X-Factor 風險 3 : 切斷毛囊 Transection
切斷毛囊的上 1/3 |
||
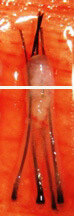 |
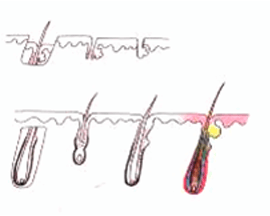 |
切斷毛囊的中 1/3 - 生長率 0% |
| 移植毛囊下部的 2/3 - 生長率 83% | ||
切斷毛囊的中段 |
||
  |
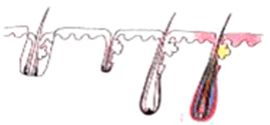 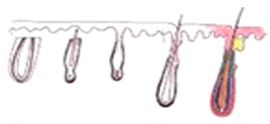 |
移植毛囊上半部 - 生長率 40% |
| 移植毛囊下半部 - 生長率 27% | ||
| 切斷毛囊的下 1/3 | ||
 |
 |
移植毛囊上 2/3 - 生長率 65% |
| 移植毛囊下 1/3 - 生長率 0% | ||
臨床證明切斷的毛囊,會有較低的生存機會。
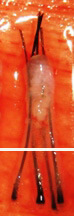
處理方案 1: 開放式的 FUT 技術
坊間的 FUT 技術,仍普遍使用閉卦式的方法,即病人坐著向前傾斜,醫生站在後面,在沒有看到毛囊的情況下,用刀切割頭皮,當然那些經驗豐富的醫生,會憑感覺調整刀片的角度,來避兔誤傷原來的頭髮。這可能適用於白種人較短的髮根,卻不適用於東方人較良的髮根。毛囊根部若在提取的過程中被切斷,未必能存活。開放式的 FUT 技術要求病人俯臥床上,醫生必須清楚看到毛囊,才能下刀。這開放式的 FUT 技術由 Dr. Pathomvanich 於 1998 年首次報導,因應要求一定的外科經驗,和額外的 30 分鐘的手術時間,雖然有很多的優點,但在全球仍未普及。
處理方案 2 : 顯微鏡下分割毛囊
FUT 採用最小的毛囊單位作移植。將毛囊單位從頭皮分割出來的過程中,中段重要部位很容易被切斷,要保留其完整性的唯一方法,是在顯微鏡放大的情況下進行分割。顯微鏡的使用最早是由美國 Dr. Limmer 於 1991 年提出的,已成為現今的黃金標準,我們使用 10 倍放大的立體顯微鏡,採用 LED 冷光照明以避免毛囊過熱,全程令毛囊保持濕潤以防止脫水。我們有七個助手同時進行分割,以縮短手術時間,增加毛囊的生存機會。
X-Factor 風險 4 : 毛囊離開人體時間
離開人體時間 ( 小時 ) |
生長率 ( % ) |
|---|---|
2 |
95 |
| 4 | 90 |
| 6 | 86 |
| 8 | 86 |
| 24 | 79 |
從表中可以看到,移植體在4小時後的存活率達到90%,但在 4 個小時後,傷亡率可高達 10% ,且隨時間增加,浪費了這些珍貴的有限資源。
處理方案
• 盡量將 FUE 提取毛的時間,限制 3 小時
• 術前精心計劃每一過程序,以縮短操作時間
• 足夠的人手來分擔工作
• 每天只進㣔一宗植髮,以便全心全力做到最好
X-Factor 風險 5 : 細胞零下冷藏結晶
這是人為傷害的一種。 研究表明,所有在零度以下長時間冷凍的移植毛囊都會死亡。 家用冰箱可能會出現溫度波動,如果不小心將冰箱的溫度設置得太低,則可能會降到 0°C 以下,並在不知情的情況下毀壞毛囊。 根據韓國 Dr Kim 的研究指出,無論移植毛囊是在室溫下還是在 4°C 下保存,在 6 小時內存活率均無顯著差異。
處理方案
• 如果可以在 4-6 小時內完成手術,則祇須將毛囊保存在室溫下
• 若將毛囊儲存在冰箱中,便須使用特殊的儲存液 Hypothermosol
• 嘗試在 6 小時內完成所有過程
X-Factor 風險 6 : 病人術後護理不當
植髮後,病人若未能正確處理移植的部位,有機會傷及移植的毛囊。
處理方案
• 提供詳細的書面術後護理指引
• 四個月內免費醫生覆診,不限次數,隨時解決任何緊急性問題
• 專業的客入服務團隊,解答您的任何顧慮
X-Factor 風險 7 : 新移植毛囊的意外脫落
移植後的第一周,可通過直接衝擊使移植毛囊脫落
處理方案
• 提供詳細的術後期活動指引
• 某些情況下可能要採用防護件敷料
X-Factor 風險 8 : 傷口感染
如果感染得到及時診斷和治療,則不會影響最終結果。
處理方案
• 針對特定情況使用抗生素
• 預防勝於治療,確保植髮在無菌環境中進行
• 所有員工必須嚴格遵守感染預防指引
• 及早處理,任何感染先兆 ( 紅、腫、痛、分泌物、化膿 ) 必須盡快聯絡本中心
X-Factor 風險 9 : 再灌注缺血性損傷
缺氧一段時間後,當毛囊細胞在植入頭皮後,突然再次暴露於氧氣時,它們可能會形成自由基。這些自由基可能導致細胞損傷,影響生長,這被稱為「 Reperfusion Ischaemic Injury 再灌注缺血性損傷 」。
處理方案
• 通過使用抗炎藥抑制組織損傷
• 將 ATP 添加到存儲溶液中,以保護移毛囊
X-Factor 風險 10 : 移植區域血液循環欠佳
若毛囊細胞在新的環境得不到充足的血液供應,會因缺氧壞死或阻礙其生長
處理方案
• 要求患者馬上停止或減少吸煙
• 盡快使用低能量激光治療,改善微循環
ATP 細胞能量液 ( 美國 )

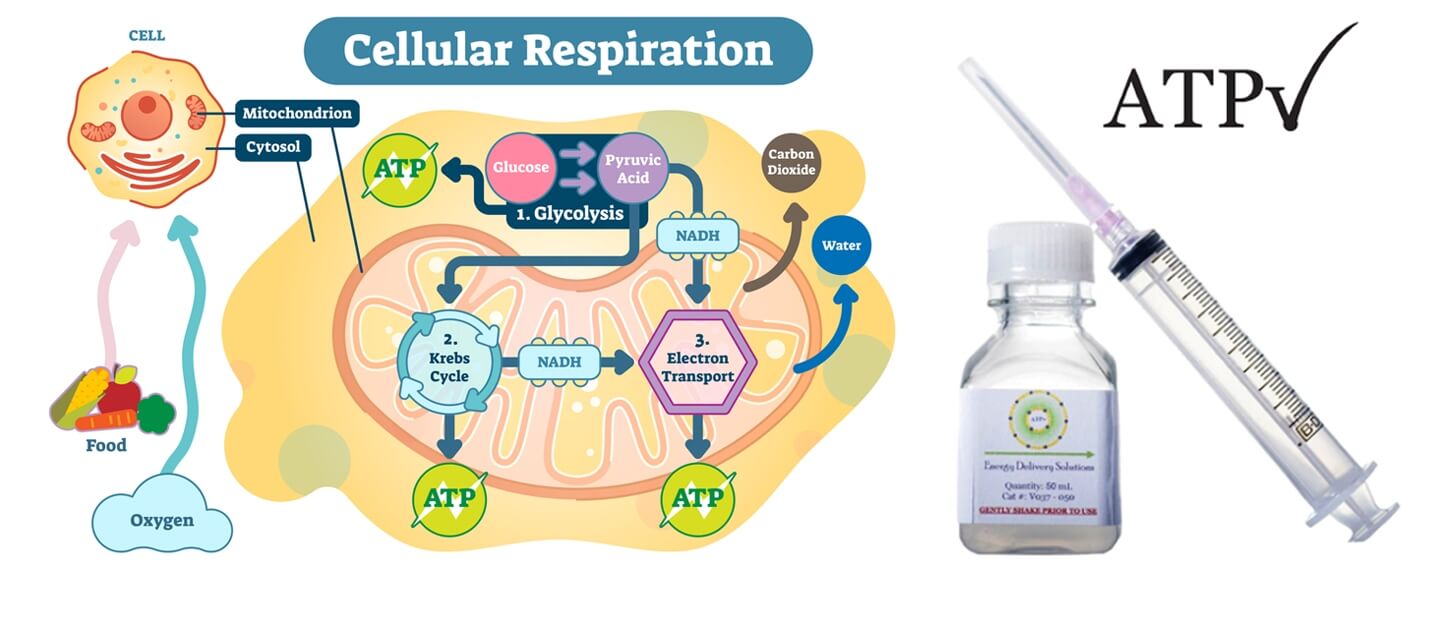
ATP 細胞能量液 ( 美國 )
ATP( 三磷酸腺苷 )是一種能量分子,可催化人體中多種重要的細胞反應。 ATP 的缺乏會導致細胞損傷,並最終導致細胞和組織的死亡。因為 ATP 的產生和調節需要氧氣,所以缺氧的組織經,常會因 ATP 的損失而受到損害。因此,ATP 對於患者傷口癒合至關重要。特別是植髮後的傷口。
2002 年,路易斯維爾大學醫學院教授 Prof. William Ehringer 發現了一種將 ATP 封存並傳遞至細胞的方法。經過 10 年的研究,最終製劑被確定為- 脂質體 ATP ( Lyposomal ATP )。 2012 年,Prof. Ehringer 在美國創立了 Energy Delivery Solutions,生產製造 ATP 的產品,協助手術後患者的傷口癒合,更後更應於於植髮。
美絲 ATP 的應用
國際植髮權威 Dr. Jerry Cooley 和我們的師 Dr. Pathomvanich 的臨床實驗表明,在毛髮移植手術中,ATP 可以加快癒合速度、並提高毛髮移植後的存活率。 2015 年我們遠飛美國,與 Prof. Ehringer 親自會面商討 ATP 的正確使用方法。Prof. Ehringer 建議我們在植髮過程中和移植後都使用 ATP:
1. 將移取的毛囊,儲存在含 ATP 的儲存液中
2. 術後 2 至 3 天之內,在家中將 ATP 製劑噴到受植髮的頭皮上
回港後在選定對像進行了一年多的臨床試驗,結果令人滿意。自 2016 年 10 月起,我們向所有植髮人士提供 ATP。由於 ATP 的半衰期很短,因此我們必須每隔幾週,便從美國進口一次,但我們深信所付出的努力和支出是值得的。
低能量激光療法 LLLT

本中心設有獨立激光治療室,毛囊從捐髮區取出,移植到禿髮的部位,需要至少一星期才會重生接駁血管,這短暫性的缺氧,會逼使毛囊進入休止期,所以九成之上移植的毛囊髮梢,會於手術後六個星期內脫落,六至八個月內再重新長出。
低能量激光療法 Low Level Laser Therapy ( 簡稱 LLLT ) ,能有效地維持毛囊細胞的正常生長和功能,LLLT 的光波被細胞的線粒體 mitochondria 吸收後,會增加細胞呼吸,並通過活性氧的誘導,激活細胞核的轉錄因子。本中心為了要優化移植毛囊的生長,從美國訂購了一部 Sunetic G Model 激光罩,供客人在植髮後使用。植髮後使用低能量激光,能增加了照射部位血液供應,減少短暫性脫髮 Shock Loss ,有助縮短移植毛囊的休止期,令頭髮更迅速地長出。
詳細內容
相關醫學文獻
• Aby Mathew. A review of Cellular Bippreservation Consideration During Hair Transplantation. Hair Transplant Forum International, Vol 23 No. 1, January/February 2013
• Baust, J.G. In: J.G. Baust and J.M. Baust, eds. Advances in Biopreservation. CRC Press, 2007; 1-14.
• Snyder, K.K., et al. Biological packaging for the global cell and tissue therapy markets. BioProcessing Journal. 2004(May/June); 1-7.
• Reyes, A.B., J.S. Pendergast, and S. Yamazaki. Mammalian peripheral circadian oscillators are temperature compensated. J Biol Rhythms. 2008; 23:95-98.
• Allen, F.M. Physical and toxic factors in shock. Archives of Surgery. 1939; 38:155-180.
• Bigelow, W.G., W.K. Lindsay, and W.F. Greenwood. Hypothermia: its possible role in cardiac surgery: an investigation of factors governing survival in dogs at low body temperature. Annals of Surgery. 1950; 132:849-866.
• Swan, H., et al. Hypothermia in surgery: analysis of 100 clinical cases. Annals of Surgery. 1955; 142:382-400.
• Collins, G.M., M. Bravo-Shugarman, and Pl. Terasaki. Kidney preservation for transplantation: initial perfusion and 30 hours ice storage. Lancet. 1969; 2:1219.
• Taylor, M.J., et al. A new solution for life without blood: asanguineous low flow perfusion of a whole-body perfusate during 3 hours of cardiac arrest and profound hypothermia. Circulation. 1995; 91:431-444.
• Van Buskirk, R.G., et al. Assessment of hypothermic storage of normal human epidermal keratinocytes (NHEK) using Alamar Blue. In Vitro Toxicology. 1996; 9:297-303.
• Mathew, A.J., J.G. Baust, and R.G. Van Buskirk. Optimization of HypoThermosol for the hypothermic storage of cardiac cells—addition of EDTA. In Vitro Toxicology. 1997; 10(4):407-415.
• Mathew, A.J., et al. Vitamin E and EDTA improve the efficacy of HypoThermosol—implication of apoptosis. In Vitro Toxicology. 1999; 12(3):163-172.
• Dahdah, N.S., et al. Effects of HypoThermosol, an experimental acellular solution for tissue preservation and cardiopulmonary bypass, on isolated newborn lamb coronary vessels subjected to ultraprofound hypothermia and anoxia. Cryobiology. 1999; 39:58-68.
• Mathew, A.J., J.G. Baust, and R.G. Van Buskirk. Improved hypothermic preservation of human renal cells through suppression of both apoptosis and necrosis. Cell Preservation Technology. 2003; 1:239-254.
• Baust, J.M., et al. Transplantation diagnostics: utilization of protein microarray analysis to determine kidney status and transplantation efficacy. Cell Preservation Technology. 2004; 2(2):81.
• Mathew, A.J., et al. Cell preservation in reparative and regenerative medicine: evolution of individualized solution composition. Tissue Engineering. 2004; 10:1662-1671.
• Snyder, K.K., et al. Biological packaging for the global cell and tissue therapy markets. BioProcessing Journal. 2004; 3(3):39.
• Van Buskirk, R.G., et al. Hypothermic storage and cryopreservation: the issues of successful short-term and long term preservation of cells and tissues. BioProcess Int’l. 2004; 2(10):42.
• Baust, J.M. Advances in media for cryopreservation and storage. BioProcess International. 2005; 3:46-56.
• Snyder, K.K., et al. Enhanced hypothermic storage of neonatal cardiomyocytes. Cell Preservation Technology. 2005; 3(1):61-74.
• Mathew, A.J. I’m losing cell viability and function at different points in my process, and I don’t know why! BioProcess Int’l. 2010; 8(6) 54-7.
• Ikonomovic, M., et al. Ultraprofound cerebral hypothermia and blood substitution with an acellular synthetic solution maintains neuronal viability in rat hippocampus. CryoLetters. 2001; 22:19-26.
• Lodish, H.F., et al. Transport across cell membranes. In: S. Tenney, ed. Molecular Cell Biology. 4th Edition. New York: W.H. Freeman, 2000; 590-591.
• MacKnight, A.D.C., and A. Leaf. Regulation of cellular volume. Physiology Review. 1977; 57:510.
• Martin, D.R., et al. Primary cause of unsuccessful liver and heart preservation: cold sensitivity of the ATPase system. Annals of Surgery. 1972; 175:11.
• Boutilier, R.G. Mechanisms of cell survival in hypoxia and hypothermia. J of Experimental Biology. 2001; 204:3171-3181.
• Toledo-Pereyra, L.H., A.J. Paez-Rollys, and J.M. PalmaVargas. Science of organ preservation. In: L.H. ToledoPereyra, ed. Organ Procurement and Preservation for Transplantation. Landes Bioscience, 1997; 1-16.
• Rehncrona, S., B.K. Siesjo, and D.S. Smith. Reversible ischemia of the brain: biochemical factors influencing restitution. ActaPhysioliogy Scandinavia. 1979; Suppl 492:135.
• Cotterill, P. ISHRS survey majority using chilled saline. W. Reed Personal communication, December 2012. Reed, W. Personal communication, December 2012.
• Perez-Meza, D., M. Leavitt, and M. Mayer. The growth factors. Part 1: clinical and histological evaluation of the wound healing and revascularization of the hair graft after hair transplant surgery. Hair Transplant Forum Int’l. 2007; 17(5):173.
• Perez-Meza D. Wound healing and revascularization of the hair transplant graft: role of the growth factors. In: W. Unger and R. Shapiro, eds. Hair Transplantation, 4th Ed. Marcel Dekker, New York, 2004; 287-294.
• Cooley, J. Ischemia-reperfusion injury and graft storage solutions. Hair Transplant Forum Int’l. 2004; 14(4):121,127,130.
• Parsley, W.M., and D. Perez-Meza. Review of factors affecting the growth and survival of follicular grafts. J Cutan Aesthet Surg. 2010; 3(2):69-75.
• Limmer, R. Micrograft survival. In: D. Stough, ed. Hair Replacement. Mosby Press, 1996; 147-149.
• Kim, J.C., and S. Hwang. The effects of dehydration, preservation temperature and time, and hydrogen peroxide on hair grafts. In: W.P. Unger and R. Shapiro, eds. Hair Transplantation, 4th Ed. New York: Marcel Dekker, 2004; 285-286.
• Hwang, S.J., et al. The effects of dehydration, preservation temperature and time on the hair grafts. Annals of Dermatology. 2002; 14:149-152. 37. Krugluger, W., et al. Enhancement of in vitro hair shaft
elongation in follicles stored in buffers that prevent follicle cell apoptosis. Dermatol Surg. 2004; 30:1-5.
• Krugluger, W., et al. New storage buffers for micrografts enhance graft survival and clinical outcome in hair restoration surgery. Hair Transplant Forum Int’l. 2003; 13(3):333-334.
• Van Buskirk, R.G., et al. Navigating the post-preservation viability fog: assay standardization for cell and tissue therapy applications. Genetic Engineering News. 2006; 26(19):38-39.
• Van Buskirk, R. Viability and functional assays used to assess preservation efficacy: the multiple endpoint/tier approach. In: J.G. Baust and J.M. Baust, eds. Advances in Biopreservation. CRC Press-Taylor and Francis Publishing: New York, 2006.
• Belzer, F., and J. Southard. Principles of solid-organ preservation by cold storage. Transplantation. 1988; 45(4):673-676.
• Taylor, M.J. The role of pH and buffer capacity in the recovery of function of smooth muscle cooled to –13°C in unfrozen media. Cryobiology. 1982; 19:585-60.
• Taylor, M.J., and Y. Pignat. Practical acid dissociation constants, temperature coefficients and buffer capacities for some biological buffers in solutions containing dimethyl sulfoxide between 25 and –12°C. Cryobiology. 1982; 19:99-109.
• Fujita, J. Cold shock response in mammalian cells. J Mol Microbiol Biotechnol. 1999; 1(2):243-255.
• Plesnila, N., et al. Effect of hypothermia on the volume of rat glial cells. Journal of Physiology. 2000; 523.1:155-162.
• Tseng, Y-C, et al. Exploring uncoupling proteins and antioxidant mechanisms under acute cold exposure in brains of fish. PLoS ONE. 2011; 6(3):1-15.
• Corwin, W.L., et al. The unfolded protein response in human corneal endothelial cells following hypothermic storage: Implications of a novel stress pathway. Cryobiology. 2011; 63(1):46-55.
• Baust, J.M. Overview of hypothermic storage. Hair Transplant Forum Int’l. 2006; 16(2):53.
• Cosentino, L.M., et al. Preliminary report: evaluation of storage conditions and cryococktails during peripheral blood mononuclear cell cryopreservation. Cell Preservation Technology. 2007; 5:189-204.
• Baust, J.M., R.G. Van Buskirk, and J.G. Baust. Cell viability improves following inhibition of cryopreservation-induced apoptosis. In Vitro Cell and Developmental Biology. 2000; 36:262.
• Baust, J.M., et al. A molecular basis of cryopreservation failure and its modulation to improve cell survival. Cell Transplantation. 2001; 10:561.
• Baust, J.M., R.G. Van Buskirk, and J.G. Baust. Gene activation of the apoptotic caspase cascade following cryogenic storage. Cell Preservation Technology. 2002; 1:63.
• Baust, J.M. Molecular mechanisms of cellular demise associated with cryopreservation failure. Cell Preservation Technology. 2002; 1:17.
• Anderson, R.V., M.G. Siegman, and R.S. Balaban. Hyperglycemia increases cerebral intracellular acidosis during circulatory arrest. Annals of Thoracic Surgery. 1992; 54:1126-1130.
• Ely, S.W., and R.M. Berne. Protective effects of adenosine in myocardial ischemia. Circulation. 1992; 85:893-904.
• Bessems, M., et al. Preservation of rat livers by cold storage: a comparison between the University of Wisconsin solution and HypoThermosol. Ann Transplant. 2004; 9(2):35-37.
• Povsic, T., et al. A double-blind, randomized, controlled, multicenter study to assess the safety and cardiovascular effects of skeletal myoblast implantation by catheter delivery in patients with chronic heart failure after myocardial infarction. American Heart Journal. 2011; 162(4):654-662.
• Powell, R., et al. Interim analysis results from the RESTORE-CLI, a randomized, double-blind multicenter phase II trial comparing expanded autologous bone marrow-derived tissue repair cells and placebo in patients with critical limb ischemia. J of Vasc Surg.2011; 54(4):1032-1041.
• Ginis, I., B. Grinblat, and M. Shirvan. Evaluation of bone marrow-derived mesenchymal stem cells after cryopreservation and hypothermic storage in clinically safe medium. Tissue Engineering Part C Methods. 2012; 18(6):453-463.
• Lowe, N.J., P.L. Lowe, and J. St Clair Roberts. A phase IIa open-label dose-escalation pilot study using allogeneic human dermal fibroblasts for nasolabial folds. Dermatol Surg. 2010;
36(10):1578-1585.
• Raposio, E., et al. Effects of cooling micrografts in hair transplantation surgery. Dermatol Surg. 1999; 25:705-707.
• Jiange, Q., et al. How long can hair follicle units be preserved
at 0 and 4°C for delayed transplant? Dermatol Surg. 2005; 31:23-26.
• Kurata, S., et al. Viability of isolated single hair follicles preserved at 4°C. Dermatol Surg. 1999; 25:26-29.
• Beehner, M.L. Notes from the Editor Emeritus. Hair Transplant Forum Int’l. 2005; 15(6):193-195.
• Cooley, J.E. Successful extended storage of hair follicles using hypothermic media with liposomal ATP. Translational Regenerative Medicine Forum. 2010.
• Beehner, M.L. 96-hour study of FU graft “out-of-body” survival comparing saline to HypoThermosol/ATP solution. Hair Transplant Forum Int’l. 2011; 21(2):1, 37.
• Ehringer, W.D. New horizons in storage solutions and additive agents in organ transplantation. Norwood Lecture, ISHRS 2011 Annual Scientific Meeting.


